قانون بویل ماریوت در مبحث گازها مطرح می شود و بیان می دارد که در حالنی که جرم و دمای گاز ثابت باشد فشار گاز با دمای آن نسبت معکوس دارد. یعنی وقتی فشار گاز زیاد می شود حجم کم می شود و وقتی حجم زیاد می شود فشار کم می شود. این قانون در سال 1662 توسط شیمیدان رابرت بویل انگلیسی درسال 1662 ارائه شده است.
این قانون را به صورت ریاضی می توان این گونه ارائه کرد:
PV=k
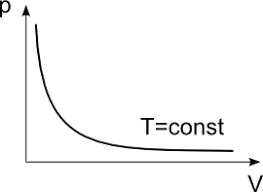
این قانون برای گازها کاربرد دارد
شبیه سازی قانون بویل ماریوت
موقعی که بادکنک پراز هوا فشرده می شود حجم هوای داخل بالن ک که اشغال شده ‚ کاهش پیدا می کند. این نتیجه افزایش فشار برروی بالن است که ننیجه قانون بویل است.
مثالهای قانون بویل ماریوت :
1. مقداری فیکس شده از یک گاز به حجم معادل 400کیلوپاسکال فشار برروی دیواره ظرف وارد می کند .اگر در شرایط دمای ثابت و مقدارگاز ثابت ‚ این گاز به ظرف دیگر به حجم 3لیتر منتقل شود چه فشاری اعمال می کند؟
چون حجم ظرف سه برابر شده فشار نصف می شود و در این شرایط فشار معادل 133.33 کیلو پاسکال بر دیواره های ظرف وارد می کند.
2. گاز ی فشار 3کیلو پاسکال برروی دیواره های یک ظرف واردکند که حجم آن نامشخص است و اندازه گیری آن سخت است. هنگامی که این گاز در ظرف 10لیتری تخلیه می شود فشار به 6 کیلو پاسکال افزایش یابد . با فرض ثابت بودن دما و جرم گاز‚ حجم ظرف اول را پیداکنید؟
چون در حالت اول فشار نصف حالت دوم است بنابراین حجم دو برابر است که حجم ظرف معادل 20 لیتر می شود.
3.چرا این قانون در شرایط فشار بالا خوب جواب نمی دهد؟
این قانون در شرایط قشار پائین اعمال می شود و در شرایط فشار بالا صادق نیست. بابد دانست گازها در فشار بالا مانند گاز ایده آل عمل می کنند.

