الکتروپولیش
الکتروپولیش :
الکتروپولیش یک فرآیند الکتروشیمیایی است و معکوس عملیات آبکاری می باشد .پیشتر در طرح های تولیدی سود آور شیمیایی با روش های تولید برخی از مواد شیمیایی آشنا شدیم . اکنون به بررسی این روش می پردازیم .این روش به این ترتیب است که به جای این که فلز بر روی سطح بنشیند ، از روی آن جدا می شود . وقتی که یک سطح فلزی الکتروپولیش می شود . اشعه های نور را در خطوط افقی بازتاب می کند بنابراین سطح همانند یک آینه عمل می کند . در سطوح زبر و پولیش نشده نور در الگویی تصادفی بازتاب می شود ، بنابر هیچ تصویری دیده نمی شود .
درجه موفقیت پولیش یک سطح به فلز پایه بستگی دارد .
همچنین دمای الکترولیت ، میزان جریان و ولتاژ ، مدت زمان این فرایند بر بروی کیفیت کار تاثیر گذارند .
مزایای الکتروپولیش :
این فرایند محصولی با ویژگی های خوب تولید می کند : داشتن یک سطح صاف تر ، ظاهری بهتر ، مقاومت خوردگی بهتر وقتی که هیچ پوشش سطحی دیگری وجود ندارد ، بازتابش نور و حرارت بیشتر و … از مزایای الکتروپولیش می باشند .
از محدودیت های این فرایند این است که نمی تواند عیب و نقص سطح فلز را بپوشاند . آلیاژ های چند فازی که یک فاز آن در مقابل حل شدن آندی مقاومت می کنند معمولا مناسب این فرایند نیستند . سطوح پوست پرتقالی ، سطوح ریخته گری ریال خراش های عمیق بعد از الکتروپولیش نتیجه رضایت بخشی نخواهند داشت .
انواع فلز های مناسب الکتروپولیش :
انواع فلز ها می توانند الکتروپولیش شوند . اما بهترین نتیجه مربوط به فلزاتی است که مرز های دانه ای خوب دارند و در شکاف های و درز ها ناخالصی های غیر فلزی نداشته باشند . فلزاتی که شامل مقدار زیادی سیلیس ، سرب یا سولفور هستند معمولا برای این فرایند مناسب نیستند . استنلس استیل جزو فلزاتی است که به خوبی الکتروپولیش می شود . در کنار استنلس استیل ، فلزات دیگری نظیر کربن استیل ، مس ، برنج ، بریلیم ، مس ، فسفر مس ، و گرید های زیادی از آلومینیوم می توانند الکتروپولیش شوند . سایر فلزاتی که می توانند الکتروپولش شوند عبارتند از آلومینیوم ، طلا ، نقره ، تانتالیوم ، تیتانیوم ، تنگستن و وانادیوم می باشند .

کاربرد های الکتروپولیش :
قطعات قالب خورده ، جوش خورده ، ریخته گری ، کشش کاری شده ، فورج شده و وسایل سیمی کاندیدای مناسبی جهت این فرایند می باشند . به طور کلی قطعات ساخته شده از استنلس استیل جهت مصارف زیر الکتروپولیش می شوند :
لوازم بیمارستانی ، تجهیزات پزشکی و جراحی ، لبنیاتی ، فرآوری غذا و نوشیدنی ، ایمپلنت های استخوان و مفاصل ، تجهیزات مکنده ، تجهیزات آسیاب کاغذ ، لوازم الکترونیک و ارتباطات و …
محلول های الکتروپولیش :
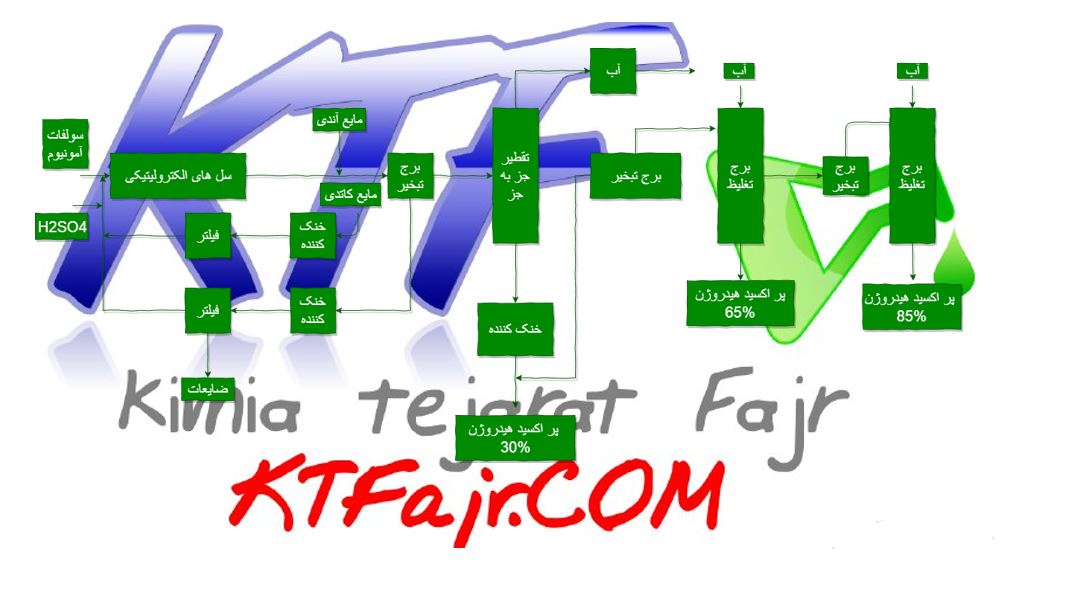
محلول های گوناگونی برای این فرایند استفاده می شود که یا اسیدی یا قلیایی می باشند . اصولا محلول الکتروپولیش اسیدی است و بر پایه یکی از گرید های اسید سولفوریک به همراه یک اسید دیگر است . اساسا دو نوع محلول الکتروپولیش وجود دارد . ۱- محدود ۲- نامحدود
مراحل عملیات
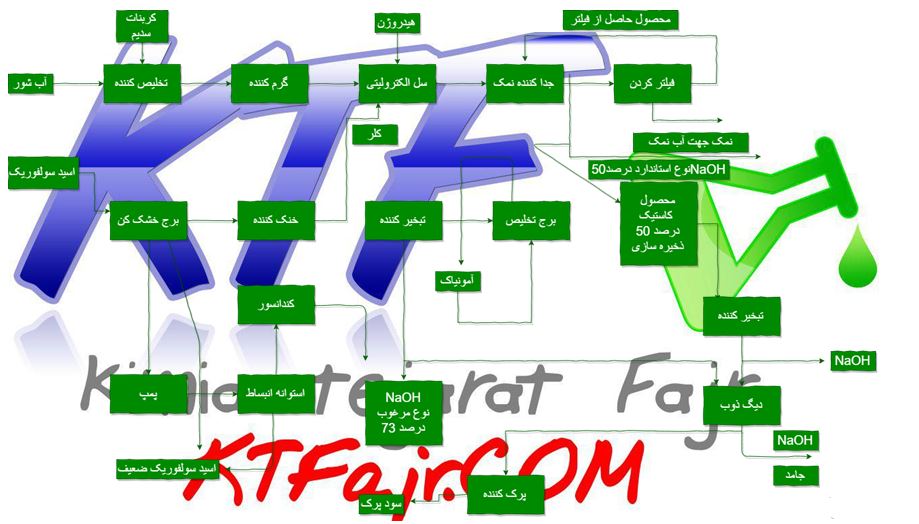
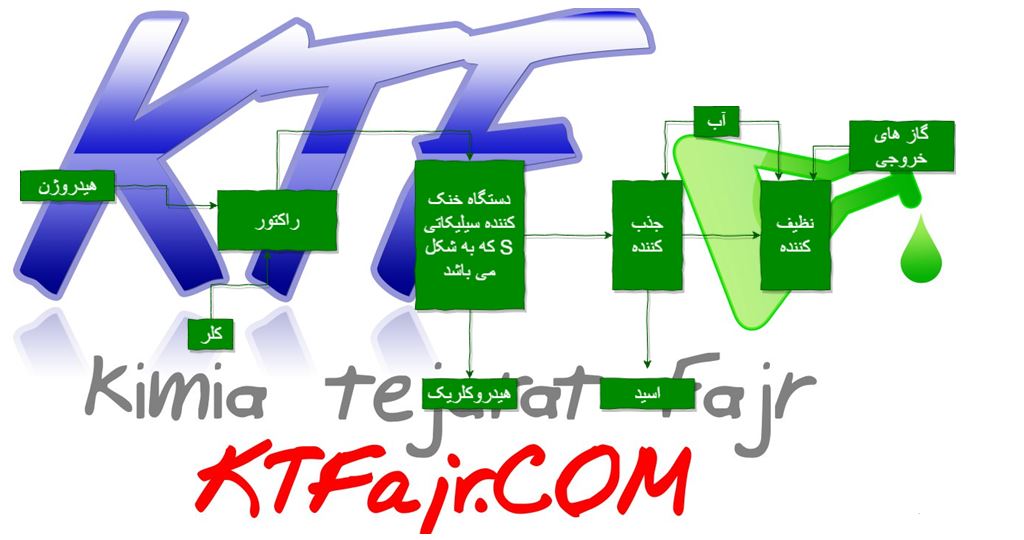
وقتی یک قطعه الکتروپولیش می شود ، مقدار کمی از فلز برداشته می شود . فلز در ترکیب با اجزا حمام به شکل نمک فلزی در ته وان رسوب می کند . این حمام یک عمر نامحدود دارد . حمام های محدود در حالتی است که نمک های فلزی به صورت محلول در حمام قرار می گیرند و در ته وان رسوب نمی کنند. وقتی که میزان این نمک ها در محلول به بالاترین حد خود رسید ، حمام باید تخلیه شده و محلول جدید جایگزین شود . این شیوه بسیار گران بوده و مقرون به صرفه نمی باشد . معمولا محلول الکتروپولیش ترکیبی از چند اسید و اسید سولفوریک می باشد . در همگام عمل الکتروپولیش اکسیژن در آند و هیدروژن در کاتد آزاد می شود . گاهی اوقات اکسیژن آزاد شده در آند به همراه اکسیژن موجود در هوا باعث انفجار هیدروژن می شود که با صدای بلندی همراه است اما اساسا خطرناک نیست .
تجهیزات الکتروپولیش :
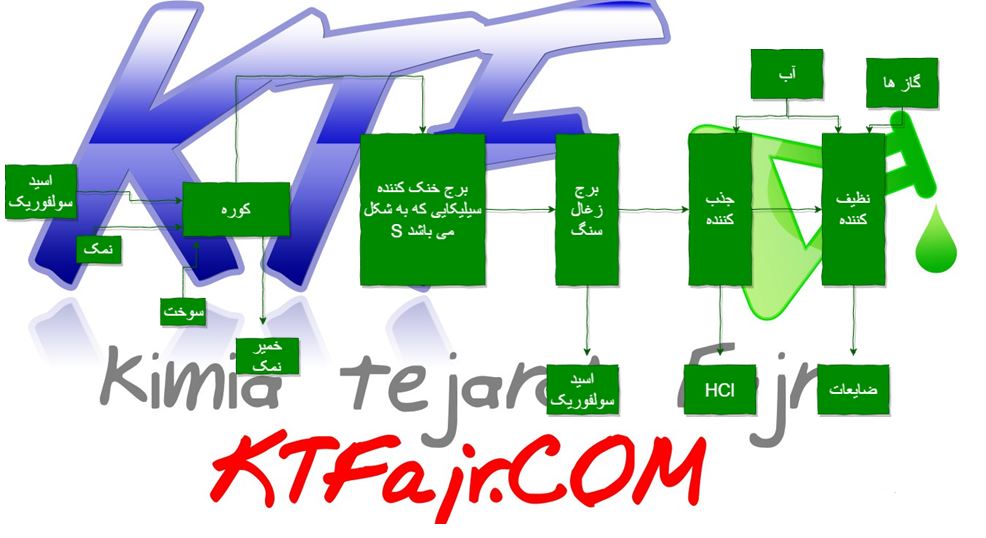
اسید های غلیظ نظیر اسید سولفوریک ، رکتیفایر جهت ایجاد جریان مستقیم ، تانک مناسب الکتروپولیش تلاطم ، تهویه ، وسایل و تجهیزات ایمنی – رکها (آویز ها ) گرمایش و سرمایل محلول
مراحل انجام الکتروپولیش :
۱- انتقال به رک
۲- تمیز کاری قطعه
۳- شستشو
۴- الکتروپولیش
۵- شستشو
۶- پسیو کردن
۷- شستشو
۸- شستشوی گرم
۹- خشک کردن
برای انجام یه الکتروپولیش خوب ، مرحله تمیز کاری بسیار با اهمیت می باشد . در این مرحله قطعات توسط چربی گیر های قلیایی و یا حلالی کاملا تمیز و بعد از عملیات الکتروپولیش انجام می شود .
روشهای تمبز کاری قبل از عملیات
روشهای تمبز کاری متعددی قبل از عملیات استفاده می شود که شامل موارد ذیل است
پیکلینگ(Pickling):
پیکلینگ هر گونه اکسید مخصوصا حرارتی (که از جوش بجای مانده اند ) و آنهایی که از خوردگی و روشهای دکلره کردن برجای ماندند استفاده می شود. آن یک سطح تمیزی ایجاد می کند که باعث می شود شرایط لازم برای خود پسیو کردن طبیعی استنلس استیل به وقوع بپیوندد. ترکیب عمومی که برای این جهت استفاده می شود شامل اسید نیتریک و اسید فلوئوریدریک است .زمان عملیات بستگی به دمای محلول و درجه آلودگی دارد.
رابطه الکتروپولیش و اصطکاک :
این فرآیند چون زبری سطخ را کمک می کند ضریب اصطکاک فلزات را کم می کند . در حقیقت در این فرایند پستی و بلندی سطح از بین می رود و سطح گرد می شود. و صریب اصطکاکی بدست می آید که تقریبا معادل ۰٫۲۵ سطح مکانیکی تکمیل شده است.
توجهات و نکات قابل توجه :
پولیش نمی تواند حفره ها درزها و اجزای غیر فلزی را پوشش دهد . و هر جا آلیاژ چند فلزی در دسترس بود که فاز غالب آن در برابر انحلال آندی مقاوم بود این آلیاژ برای پولیش کاری مناسب نیست
تصفیه پساب :
برای تصفیه پساب این فرایند نیز ار روش ترکیب شیمیایی استفاده می شود . بدین ترتیب که آب های حاصل از شستشو در یک مخزن جمع آوری شده و از طریق کنترل Ph تا عدد ۹ کلیه فلزات رسوب می کنند. (درباره تنظیم PH آب بیشتر بخوانید). در صورتی که در پساب حاصل از این فرایند کروم شش ظرفیتی موجود باشد ، باید این کروم تبدیل به کروم سه ظرفیتی که برای محیط زیست مضر نیست تبدیل گردد که این کار از طریق افزودن سولفیت سدیم انجام می شود . پس از تنظیم ph می توان از طریق افزودن یک پلی الکترولیت ذرات ریز را به ذرات درشت تبدیل کرد .
جداسازی پساب:
پس از گذشتن چند ساعت که به زمان ماند مشهور است ، این ذرات در کف مخزن رسوب می کنند که می توان آنها را از طریق یک فیلتر پرس به صورت کیک خشک جدا نمود و یا در یک حوضچه شنی خشک کشده و جدا نمود .